La biotecnologia si evolve a ritmi rapidissimi e offre un grande potenziale di applicazione in medicina, farmacia e chimica nonché nel settore agroalimentare. Tuttavia, in molti casi è ancora difficile valutare i rischi che si celano dietro i nuovi tipi di modifiche al patrimonio genetico di organismi viventi
Testo: Nicolas Gattlen
Non passa settimana senza che la biotecnologia sia presente nei media. Di recente abbiamo potuto leggere che al Roslin Institute di Edimburgo (GB) alcuni ricercatori hanno fatto nascere maiali immuni al virus PRRSV, l’agente patogeno di una malattia dei maiali. I ricercatori sono riusciti a riconfigurare alcuni componenti del DNA del genoma del maiale in modo da impedire al virus di entrare nelle cellule e di moltiplicarvisi. Inoltre, in vari Paesi dell’UE sono condotti esperimenti in ambiente naturale con pioppi geneticamente modificati. Queste piante cresceranno più velocemente, produrranno più biomassa e meno lignina: un grande vantaggio, dal momento che nella produzione di carta e biocarburanti l’eliminazione di questa sostanza richiede un processo costoso.
Altra notizia che di recente ha avuto forte risalto nei media: il Burkina Faso prevede di emettere nell’ambiente zanzare geneticamente modificate, i cui discendenti siano al 90 per cento maschi (contro la proporzione naturale del 50 %). La popolazione di zanzare risulterà così fortemente ridotta e la malaria potrà essere arginata, in quanto trasmessa solo dalle zanzare femmina.
Efficienza, precisione, convenienza
Questi sono solo tre esempi dell’attuale spinta allo sviluppo basata su un’intensa attività di ricerca nel campo della biologia molecolare in combinazione con la microbiologia e la genetica, ma anche con le tecnologie dell’informazione e dell’automazione. Le nuove tecniche di modifica genetica mirata, come il CRISPR/Cas (cfr. riquadro), hanno un potenziale particolarmente interessante perché sono efficienti, precise, poco costose e quindi ampiamente accessibili. A differenza dell’ingegneria genetica classica, impiegata soprattutto per trasferire informazioni genetiche tra specie diverse (transgenesi), le tecniche di editing genetico come il CRISPR/Cas permettono di modificare il genoma in modo mirato senza introdurre geni estranei alla specie. Questi metodi funzionano insomma come una sorta di «forbici genetiche», con le quali è possibile realizzare tagli in punti precisi del genoma, disattivando alcuni geni. Permettono anche di rimpiazzare segmenti di DNA difettosi o di inserire nuove sequenze genetiche in un organismo – non solo geni isolati, ma anche gruppi e combinazioni di geni in diversi punti del genoma.
I progressi più recenti nel campo della biotecnologia hanno portato a un notevole aumento delle applicazioni nel settore non umano, soprattutto in ambito farmaceutico, dove microrganismi geneticamente modificati sono impiegati per produrre medicamenti e vaccini, nonché nella medicina (terapia genica, diagnostica), nell’agricoltura (piante coltivate), nella silvicoltura (alberi destinati alla produzione di legno e carta) e nell’industria, che utilizza alghe, funghi o batteri geneticamente modificati per produrre oli, enzimi, vitamine e aromi.
Anche nell’allevamento l’utilizzo dell’ingegneria genetica apre la strada a nuove opportunità. In questo caso l’accento è posto sulla resistenza alle malattie infettive, sull’aumento della massa muscolare, sull’eliminazione di alcuni allergeni nel latte o sul miglioramento delle proprietà della lana. Finora questi progetti sembrano più promettenti di quelli dell’ingegneria genetica classica. Sono già sul mercato pesci da acquario fluorescenti o prodotti a base di salmone geneticamente modificato, che cresce più rapidamente pur avendo bisogno di meno nutrimento. Per il momento, in Svizzera, entrambi sono vietati, in quanto l’allevamento e la messa in circolazione di vertebrati geneticamente modificati è autorizzata solo a fini scientifici, terapeutici e diagnostici sull’uomo o sugli animali.
Alla fine del 2018, poco prima di un’importante conferenza sull’editing del genoma umano, una notizia diffusa a sorpresa ha destato scalpore: la nascita di due gemelli geneticamente modificati con la tecnica del CRISPR/Cas e immuni al virus dell’HIV. Da alcuni anni era chiaro che il CRISPR/Cas potrebbe essere applicato anche agli esseri umani. Tuttavia, la comunità scientifica è concorde sul fatto che almeno per il momento vanno evitate modifiche ereditarie negli esseri umani. Questa notizia ha sollevato a livello mondiale un’ondata di discussioni sulla libertà e gli obiettivi della ricerca, e sottolineato la necessità di formulare regole più stringenti. In Svizzera, simili interventi sul genoma umano sono vietati.
Sistemi biologici artificiali
Un ulteriore impulso è atteso dalla biologia di sintesi, un ambito di ricerca interdisciplinare recente che si colloca all’intersezione tra biologia molecolare, chimica, ingegneria, biotecnologia e tecnologie dell’informazione. Ricercatori di varie discipline lavorano insieme per sviluppare in laboratorio sistemi biologici come cellule, molecole e tessuti, oltre che per mettere a punto o produrre organismi dotati di nuove caratteristiche.
A differenza dell’ingegneria genetica classica, non si tratta di trasferire singoli geni (estranei alla specie) in un organismo, ma di introdurvi elementi e sistemi biologici nuovi o modificati (p. es. una via metabolica con più geni coinvolti), in modo che questi producano una determinata sostanza, per esempio un medicamento, un aroma o un biocarburante. Questi processi permettono anche di ottenere materiali che nessun organismo naturale produce, come ad esempio l’1,4-butaendiolo, una sostanza chimica di base destinata alla fabbricazione di materie plastiche che si ottiene attraverso un processo di sintesi che non esiste in natura. Spesso sono pertanto impiegati geni la cui sequenza di DNA è stata definita al computer al fine di assolvere una funzione precisa.
L’impiego sempre più frequente dell’ingegneria genetica genera nuove sfide in materia di sicurezza. Dal punto di vista della protezione della natura e dell’ambiente, il problema principale riguarda l’emissione, intenzionale o meno, di organismi geneticamente modificati (OGM) nell’ambiente. Gli OGM, infatti, si comportano come gli altri organismi viventi: si riproducono, si mescolano con altri e si modificano. Oltre agli organismi, anche le modifiche genetiche apportate, che possono trasmettersi in modo indesiderato sia in verticale (attraverso la discendenza) sia in orizzontale (mediante la trasmissione di materiale genetico ad altri organismi), possono nuocere alla salute di persone e animali nonché compromettere l’ambiente e la biodiversità.
Video «What ist a Gene Drive» (in inglese)
Interventi diretti sull’ambiente
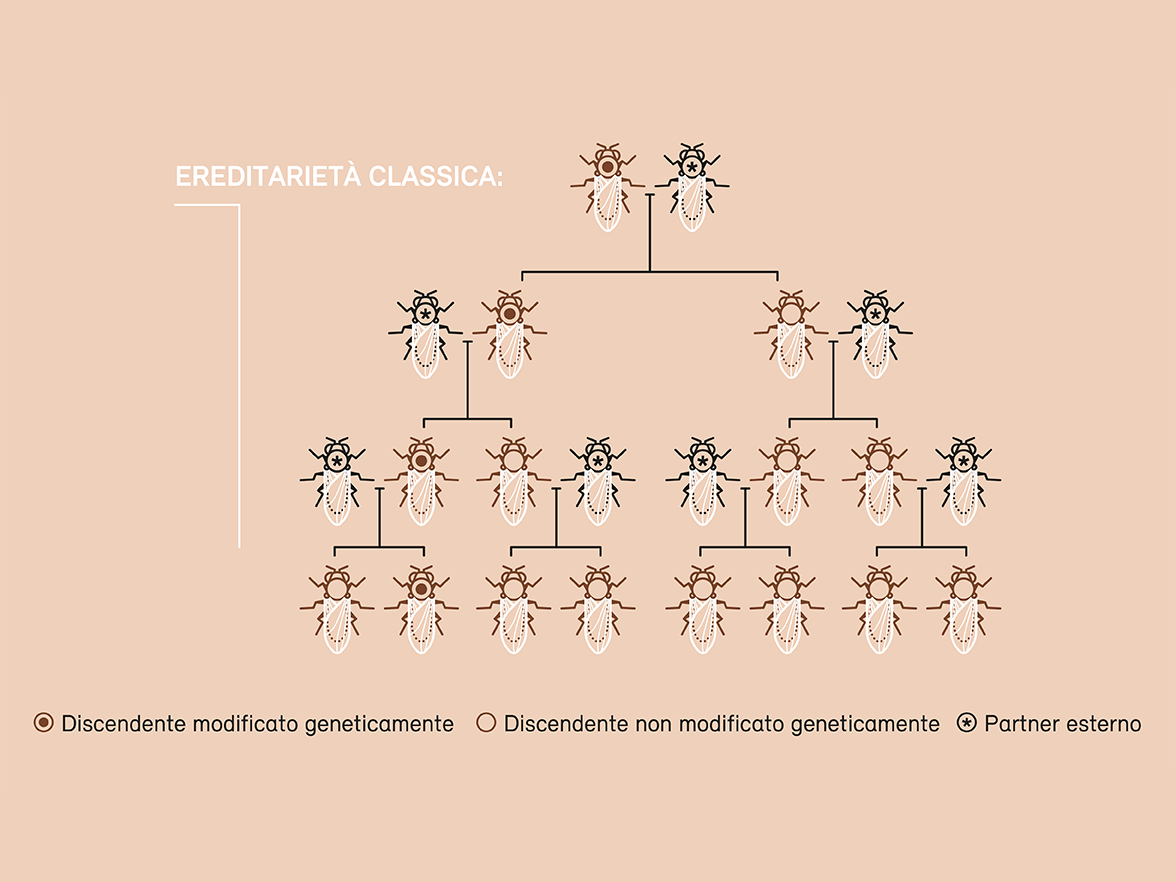
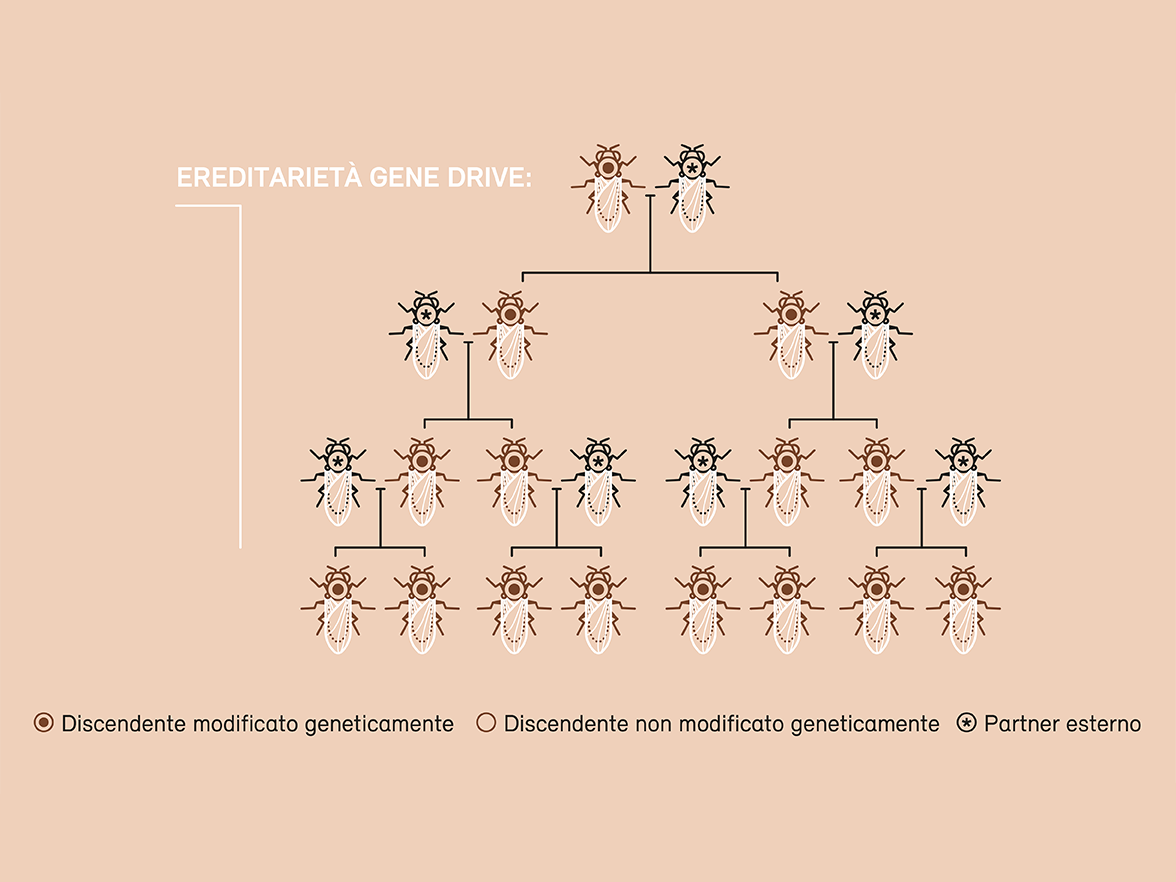
Il gene drive rappresenta una sfida particolare in materia di sicurezza e di protezione dell’ambiente. Si tratta di un metodo che permette di introdurre una mutazione genetica in una popolazione naturale e di propagarla a tutti gli individui. Mentre una modifica genetica è trasmessa solo alla metà dei discendenti attraverso la riproduzione sessuata e sparisce quindi nel corso delle generazioni, il gene drive consente di trasmettere la modifica desiderata a tutti i discendenti e di diffonderla quindi rapidamente all’interno di una popolazione. Questa tecnica offre numerose possibili applicazioni: può servire ad esempio a contenere o eliminare organismi nocivi, vettori di malattie o specie esotiche invasive. Gli esperimenti in laboratorio hanno già confermato che questo approccio funziona. Tuttavia, è praticamente impossibile valutare come l’eliminazione di una popolazione o di una specie potrà ripercuotersi sull’ecosistema o sulla biodiversità.
L’UFAM segue attentamente l’evoluzione delle biotecnologie, gestisce vari programmi di monitoraggio e garantisce il rispetto dei requisiti legali relativi alle loro applicazioni. I processi biotecnologici – siano essi utilizzati nella produzione o nella ricerca – devono svolgersi in un contesto sicuro. «La sfida risiede nel riconoscere per tempo e nel valutare i possibili rischi per le persone e l’ambiente, adottando misure per limitarli», spiega Anne Gabrielle Wüst Saucy, responsabile della sezione Biotecnologia dell’Ufficio federale dell’ambiente (UFAM). Per le tecniche nuove la valutazione dei rischi è particolarmente difficile a causa della mancanza di esperienze pregresse. «In molti casi, la scienza non è ancora in grado di valutare gli effetti delle modifiche apportate al genoma e i rischi che ne derivano». Dal momento che vi sono ragioni plausibili per temere che l’impiego degli OGM abbia conseguenze dannose per l’ambiente e la salute di piante, animali e persone, il principio di precauzione deve avere la priorità. La legge sull’ingegneria genetica (LIG) prescrive un obbligo generale di precauzione ed esige una valutazione dei rischi caso per caso come pure l’applicazione di misure di sicurezza appropriate. Inoltre, impone l’obbligo di notifica, di autorizzazione e d’informazione.
La cultura della biosicurezza
Uno dei principi fondamentali concernenti l’impiego di OGM è l’analisi caso per caso, che consiste nell’esaminare ciascun progetto dal punto di vista dei rischi che presenta e sulla base di scenari plausibili. Inoltre, si applica il principio della gradualità, che impone di acquisire sufficienti informazioni sull’organismo in questione prima di passare alla fase successiva. In generale, queste fasi corrispondono ai vari esperimenti nei cosiddetti sistemi chiusi (p. es. laboratorio, serra) e in campo aperto. Solo quando la sicurezza dell’organismo analizzato sarà confermata da dati esaustivi sarà possibile, se del caso, utilizzarlo sotto forma di prodotto. Grazie a queste regole e a una «cultura della biosicurezza» sviluppatasi negli ultimi 25 anni, in Svizzera non sono mai stati registrati incidenti gravi di diffusione incontrollata nell’ambito dell’utilizzo (volontario) di OGM. «Tuttavia, il boom delle biotecnologie cui stiamo assistendo richiede ulteriori sforzi nell’ambito della biosicurezza e della valutazione dei rischi ambientali», spiega Anne Gabrielle Wüst Saucy.
CRISPR/Cas – il «coltellino svizzero» dell’ingegneria genetica
La tecnica CRISPR si basa su un meccanismo immunitario che permette ai batteri di proteggersi dai virus. Se il batterio contrae l’infezione, il DNA del virus è ridotto in piccoli frammenti e poi integrato nelle CRISPR, delle sezioni del genoma batterico costituite da brevi e ripetute sequenze del DNA. Le sequenze di DNA introdotte servono come segnale di riconoscimento in caso di future infezioni. Alla CRISPR sono abbinati geni Cas, che contengono le istruzioni necessarie a sintetizzare una proteina in grado di tagliare i filamenti di DNA (da cui la denominazione di «forbici genetiche»). In caso di nuova infezione, le sequenze di DNA sono ritrascritte nell’RNA. Questa «sonda genetica» esamina la sequenza di DNA del virus. Quando identifica la sequenza conosciuta, si lega al DNA del virus e lo segnala alle forbici genetiche, affinché la taglino, arrestando così l’infezione.
Nel 2012 i ricercatori hanno dimostrato per la prima volta che il CRISPR/Cas poteva essere utilizzato nei microrganismi con la funzione di forbici genetiche programmate. Qualche tempo dopo è stato dimostrato che questo sistema funzionava anche in organismi di ordine superiore, come le piante e gli animali. Il processo si svolge in tre fasi. Innanzitutto, si tratta di determinare con la massima precisione la sequenza da modificare, sapendo che il genoma è composto in principio da miliardi di coppie di basi (elementi costitutivi del DNA). Questa sequenza è poi introdotta in un complesso CRISPR/Cas, che viene inserito nelle cellule dell’organismo ricevente. La cellula produce poi da sé la sonda genetica e le forbici genetiche associate. Le forbici sono poi indirizzate dalla sonda verso il punto desiderato, dove taglieranno il doppio filamento di DNA.
Infine, entrano in azione i meccanismi di riparazione propri alla cellula. Il primo meccanismo ricollega il filamento interrotto di DNA, commettendo tuttavia nella maggior parte dei casi piccoli errori. Risultato: il gene interessato non può più essere letto correttamente e non funziona più. Con il secondo meccanismo, la cellula utilizza una copia della sequenza genetica come modello per eseguire la riparazione. La sequenza in quel punto preciso può così essere modificata (in inglese to edit) praticamente a piacere, segnatamente integrando sequenze di DNA supplementari. Questi modelli possono essere prodotti artificialmente e inseriti nelle cellule. Per questa ragione si parla di strumenti di editing del genoma.
Ulteriori informazioni
Ultima modifica 29.05.2019