In der Biotechnologie schreiten die Entwicklungen rasant voran. Die modernen Verfahren bieten ein grosses Anwendungspotenzial für Medizin, Pharmazie, Chemie, Lebensmittel- und Landwirtschaft. Noch aber lässt sich in vielen Fällen nicht ermessen, welche Risiken die neuartigen Veränderungen am Erbgut von Organismen bergen.
Text: Nicolas Gattlen
Im Wochentakt berichten die Medien über Biotechnologie: Jüngst etwa war zu lesen, dass am Roslin Institute in Edinburgh (GB) Schweine gezüchtet wurden, die immun sind gegen das PRRSVirus, den Erreger einer Schweinekrankheit. Forschende haben einige wenige DNA-Bausteine im Schweinegenom so umgeschrieben, dass das Virus nicht mehr in die Zellen eindringen und sich dort vermehren kann. Und in mehreren EU-Ländern finden Freilandversuche mit genveränderten (GV) Pappeln statt: Diese sollen schneller wachsen, mehr Biomasse ausbilden und weniger Lignin produzieren – ein Vorteil, da der Stoff bei der Herstellung von Papier oder Biokraftstoffen aufwendig entfernt werden muss. Für Schlagzeilen sorgte auch eine Meldung, wonach in Burkina Faso genveränderte Mücken freigesetzt werden sollen, deren Nachwuchs zu 90 Prozent aus Männchen besteht (die natürliche Proportion beträgt 50 Prozent). So soll die Mückenpopulation massiv reduziert und die Malaria eingedämmt werden, da nur weibliche Mücken diese Krankheit übertragen.
Effizient, präzise, günstig
Das sind nur drei Beispiele für den gegenwärtigen Entwicklungsschub, der auf einer intensivierten Forschungstätigkeit in Molekularbiologie, kombiniert mit Mikrobiologie und Genetik, aber auch auf neuen Informations- und Automationstechnologien basiert. Ein besonders grosses Potenzial wird neuen Techniken zur gezielten Genveränderung wie CRISPR/Cas (siehe Box ) zugeschrieben, weil sie effizient, präzise, kostengünstig und deshalb breit zugänglich sind. Im Unterschied zu den «klassischen» Gentechniken, die meist zur Übertragung von bestimmten Erbinformationen zwischen verschiedenen Arten (Transgenese) angewandt werden, lassen sich mit Genome-Editing-Verfahren wie CRISPR/Cas gezielte Veränderungen am Genom vornehmen, ohne artfremde Gene einzufügen. Sie funktionieren wie eine «Genschere», mit der man an genau definierten Stellen im Erbgut Schnitte setzen kann, um einzelne Gene auszuschalten. Es lassen sich damit aber auch defekte DNA-Teile ersetzen oder neue Gensequenzen in einen Organismus einfügen – nicht nur einzelne Gene, sondern ganze Gengruppen und -kombinationen an verschiedenen Stellen im Erbgut.
Die jüngsten Fortschritte in der Biotechnologie haben zu einer markanten Zunahme an Anwendungen im Ausserhumanbereich geführt, insbesondere im pharmazeutischen Bereich, wo man genveränderte Mikroorganismen zur Herstellung von Medikamenten und Impfstoffen nutzt, sowie in der Medizin (Gentherapie, Diagnostik), in der Landwirtschaft (Nutzpflanzen), in der Forstwirtschaft (Bäume für die Holz- und Papierwirtschaft) und in der Industrie, wo genveränderte Algen, Pilze oder Bakterien zur Gewinnung von Ölen, Enzymen, Vitaminen oder Aromen eingesetzt werden.
Für die Tierzucht eröffnen sich dank Genome- Editing-Verfahren ebenfalls neue Möglichkeiten: Dabei geht es um Resistenzen gegen Infektionskrankheiten oder um grössere Muskelmasse, um die Unterdrückung bestimmter Allergene in der Milch oder um die Eigenschaften der Wolle. Bisher scheinen diese Projekte erfolgversprechender zu sein als solche mit klassischer Gentechnik. Bereits auf dem Markt sind genveränderte «Leuchtfische» und Fleischprodukte von GV-Lachsen, die schneller wachsen und weniger Futter brauchen. In der Schweiz sind beide nicht zugelassen, da genveränderte Wirbeltiere nur für Zwecke der Forschung, Therapie und Diagnostik an Menschen oder Tieren erzeugt und in Verkehr gebracht werden dürfen.
Unmittelbar vor einer grossen Konferenz zur Veränderung des menschlichen Erbguts Ende letzten Jahres sorgte eine Neuigkeit für einen Aufschrei. Völlig überraschend wurde bekannt, dass mit CRISPR/Cas genetisch veränderte Zwillinge zur Welt gekommen sind. Die Babys sollen dadurch gegen das HI-Virus geschützt sein. Seit vor wenigen Jahren klar wurde, dass CRISPR/Cas auch beim Menschen angewendet werden könnte, gilt in den Wissenschaften der Konsens, zumindest für den Moment bei Menschen auf vererbbare Veränderungen zu verzichten. Die Nachricht löste weltweit Diskussionen über Freiheit und Ziele der Forschung und über den Bedarf einer strengeren Regulierung aus. In der Schweiz sind solche Eingriffe ins menschliche Genom verboten.
Biologische Systeme aus dem «Labor»
Ein weiterer Entwicklungsschub wird von der Synthetischen Biologie erwartet, einem noch jungen interdisziplinären Forschungsgebiet im Schnittstellenbereich von Molekularbiologie, Chemie, Ingenieurwissenschaften, Biotechnologie und Informationstechnik (siehe Box Artikel: «Wenn man etwas baut, kann man es besser verstehen»). Forschende verschiedener Fachrichtungen arbeiten gemeinsam daran, biologische Systeme wie Zellen, Moleküle und Gewebe im Labor zu entwickeln und Organismen mit neuen Eigenschaften auszustatten oder herzustellen.
Im Unterschied zur klassischen Gentechnik werden nicht einzelne (artfremde) Gene in einen Organismus übertragen, sondern neue oder veränderte biologische Elemente und Systeme (z.B. ein Stoffwechselweg mit mehreren involvierten Genen) in Organismen eingeschleust, damit diese bestimmte Substanzen produzieren: etwa ein Medikament, ein Aroma oder einen Biotreibstoff. Es lassen sich so auch Materialien herstellen, die von keinem natürlichen Organismus produziert werden, wie beispielsweise 1,4-Butandiol, eine Grundchemikalie für die Kunststoffproduktion. Ihre Herstellung basiert auf einem Syntheseweg ohne natürliches Vorbild. Oft werden Gene verwendet, deren DNA-Abfolge am Computer entworfen wurde, damit sie einen jeweils vorgegebenen Zweck erfüllen.
Der vermehrte Einsatz von Gentechnologien stellt neue Herausforderungen an den sicheren Umgang mit damit veränderten Organismen. Für den Natur- und Umweltschutz besonders relevant sind genveränderte Organismen (GVO), die in der Umwelt freigesetzt werden oder unbeabsichtigt in die Umwelt gelangen. Denn für diese gilt wie für alle Organismen: Sie vermehren, vermischen und verändern sich. Nicht nur die Organismen, sondern auch die eingebrachten genetischen Veränderungen könnten sich in unerwünschter Weise vertikal (durch die Weitergabe an Nachkommen) oder horizontal (durch die Übertragung von genetischem Material an andere Organismen) ausbreiten und die Gesundheit von Mensch und Tier gefährden sowie die Umwelt und Biodiversität beeinträchtigen.
Video «What ist a Gene Drive» (Englisch)
Direkte Eingriffe in die Umwelt
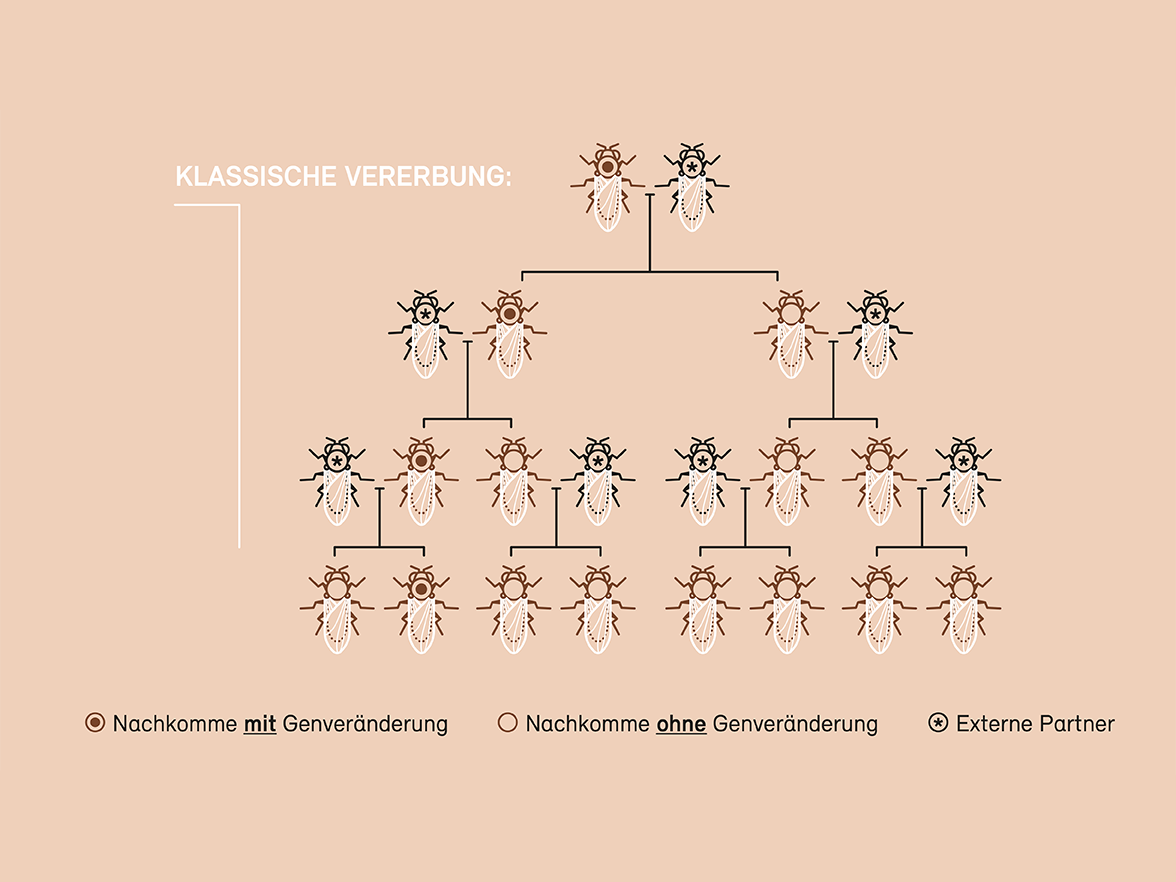
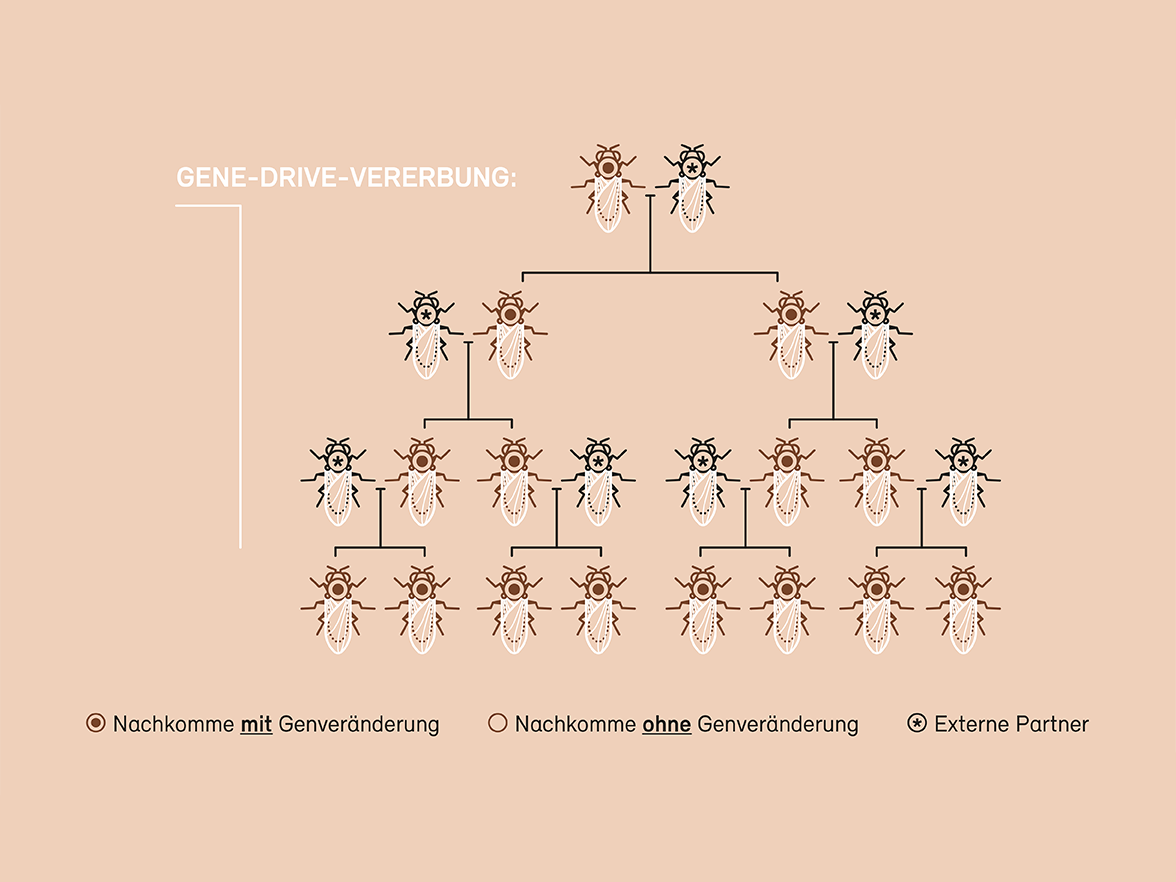
Eine besondere Herausforderung in Bezug auf Sicherheit und Umweltauswirkungen ist die Gene-Drive-Methode (siehe Grafik). Sie ermöglicht es, eine genetische Veränderung in eine natürliche Population einzubringen und auf alle Individuenauszubreiten. Während eine eingebrachte genetische Veränderung bei der geschlechtlichen Vererbung nur an die Hälfte der Nachkommen weitergegeben wird und sich über die Generationen auswächst, wird bei einem Gene Drive diegewünschte Veränderung an alle Nachkommen vererbt und kann sich so rasch in einer Population verbreiten. Die Anwendungsmöglichkeiten sind vielfältig: Mit Gene Drive lassen sich z. B. Schädlinge, Krankheitsüberträger oder gebietsfremde invasive Arten eindämmen oder ausmerzen. Dass dieser Ansatz grundsätzlich funktioniert, wurde im Labor bereits bestätigt. Wie sich die Elimination einer Population oder einer Art auf das Ökosystem und die Biodiversität auswirkt, ist indes kaum abzuschätzen.
Das BAFU begleitet die Entwicklungen im Bereich der Biotechnologie, es führt Monitoringsdurch und sorgt dafür, dass die rechtlichen Anforderungen in Bezug auf die Anwendungen der Biotechnologie eingehalten werden. Biotechnologische Prozesse – sei es in der Produktion oder in der Forschung – müssen in einem sicheren Rahmen stattfinden. «Die Herausforderung besteht darin, mögliche Risiken für Mensch und Umwelt frühzeitig zu erkennen, zu beurteilen und Massnahmen zur Begrenzung der Risiken zu ergreifen», erklärt Anne Gabrielle Wüst Saucy, Leiterin der Sektion Biotechnologie des BAFU. Bei den neuen Techniken sei die Risikoabschätzung besonders schwierig, weil Erfahrungswerte fehlten: «Die Wissenschaft kann die Bedeutung der neuartigen Veränderungen an Genomen und die daraus folgenden Risiken in vielen Fällen noch nicht ermessen. » Weil es aber plausible Gründe zur Besorgnis gibt, dass der Umgang mit GVO schädliche Folgen für die Umwelt und die Gesundheit von Pflanzen, Tieren und Menschen haben kann, gilt das Vorsorgeprinzip. Das Gentechnikgesetz (GTG) schreibt eine allgemeine Sorgfaltspflicht vor und verlangt fallorientierte Risikobewertungen und entsprechende Sicherheitsmassnahmen. Zudem gilt die Melde-, Bewilligungs- und Informationspflicht.
Kultur der Biosicherheit
Ein Grundprinzip beim Umgang mit GVO ist die Einzelfallanalyse: Jedes Vorhaben muss auf seine Risiken hin und aufgrund plausibler Risikoszenarien überprüft werden. Ausserdem gilt das Stufenprinzip: Erst wenn auf einer Stufe ausreichende Informationen über den betreffenden Organismus gewonnen wurden, geht man weiter zur nächsten Stufe. Diese Stufen bestehen typischerweise aus Versuchen im sogenannten geschlossenen System (z. B. Labor, Gewächshaus) und im Freiland. Und nur wenn mit umfangreichen Daten die Sicherheit des untersuchten Organismus belegt wurde, wird es allenfalls möglich, ihn als Produkt zu verwerten. Diesen Regelungen und einer in den letzten 25 Jahren gewachsenen «Kultur der Biosicherheit» ist es zu verdanken, dass in der Schweiz keine gravierenden unkontrollierten Freisetzungen beim(beabsichtigten) Umgang mit GVO zu verzeichnen sind. «Der aktuelle Biotech-Boom erfordert nun weitere Anstrengungen im Bereich der Biosicherheit und der Umweltrisikobewertung», erklärt Anne Gabrielle Wüst Saucy.
CRISPR/Cas – das «Schweizer Taschenmesser» der Gentechnologie
Das CRISPR-System basiert auf einem Abwehrsystem, mit dem sich Bakterien vor schädlichen Viren schützen. Bei einer Vireninfektion der Bakterie wird die DNA der eingedrungenen Viren in kleine Fragmente aufgespalten und in den CRISPR-Abschnitt eingefügt – Abschnitte im Bakterienerbgut, die aus kurzen, sich wiederholenden DNASequenzen bestehen. Die eingefügten Sequenzen dienen der Wiedererkennung bei einer späteren Infektion. An den CRISPR-Bereich gekoppelt sind Cas-Gene. Diese enthalten die Anleitung für die Herstellung eines Proteins, das DNA-Stränge zerschneiden kann («Genschere»). Bei einem erneuten Virenbefall werden die DNA-Sequenzen in RNA umgeschrieben: Diese «Gensonde» prüft die Sequenz der Viren-DNA. Stimmt diese mit dem gespeicherten Abschnitt überein, bindet die RNA an die virale DNA an und signalisiert der Genschere damit, sie zu zerschneiden und die Vireninfektion zu stoppen.
2012 konnten Forschende erstmals zeigen, wie sich CRISPR/ Cas als programmierbare Genschere in Mikroorganismen nutzen lässt. Kurz darauf gelang der Nachweis, dass dieses System auch in höheren Organismen wie Pflanzen und Tieren funktioniert. Das Verfahren läuft in drei Schritten ab: Zunächst muss im Genom, das oft aus Milliarden von Basenpaaren (DNABausteine) besteht, punktgenau die Sequenz der Stelle bekannt sein, bei der eine Änderung durchgeführt werden soll. Danach schleust man genau diese Sequenz in einen CRISPR/Cas-Komplex ein und fügt ihn in Zellen des Empfängerorganismus. Die Zelle produziert dann die Gensonde und die daran gekoppelte Genschere selbst. Die Schere wird daraufhin von der Sonde zur gewünschten Stelle geführt und zerschneidet dort den DNA-Doppelstrang.
Anschliessend treten die zelleigenen Reparaturmechanismen in Aktion. Beim ersten wird der durchtrennte DNAStrang wieder zusammengefügt – allerdings meist mit kleinen Fehlern. Die Folge: Das betreffende Gen kann nicht mehr richtig abgelesen werden und funktioniert nicht mehr. Beim zweiten Mechanismus nutzt die Zelle eine Kopie des Genabschnitts als Reparaturvorlage. Solche Vorlagen können künstlich erzeugt und in die Zellen eingefügt werden. So lässt sich die Sequenz an der Schnittstelle praktisch nach Belieben editieren – es können also auch zusätzliche DNA-Abschnitte eingefügt werden. Deshalb spricht man bei diesen Werkzeugen von Genome-Editing.
Weiterführende Informationen
Letzte Änderung 29.05.2019