Le génie génétique évolue à un rythme effréné et promet d’innombrables applications en médecine, pharmacie et chimie, ainsi que dans l’agro-alimentaire. Il reste toutefois difficile d’évaluer les risques que recèlent ces modifications génétiques d’un nouveau genre effectuées sur des organismes vivants.
Texte : Nicolas Gattlen
Il ne se passe pas une semaine sans que l’on tombe sur un article consacré aux biotechnologies. Tout dernièrement, on a pu lire qu’à l’Institut Roslin d’Édimbourg (GB), des chercheurs avaient fait naître des cochons résistant au virus du SDRP, une maladie porcine. Ils sont parvenus à reconfigurer certains constituants de leur ADN de manière à empêcher le virus de pénétrer dans leurs cellules pour s’y multiplier. Plusieurs pays de l’Union européenne mènent par ailleurs des essais en plein air avec des peupliers génétiquement modifiés, censés croître plus vite et produire davantage de biomasse et moins de lignine, un atout sensible car la fabrication de papier et de biocarburants implique l’extraction coûteuse de cette substance.
Autre nouvelle ayant fait les gros titres récemment, le Burkina Faso prévoit de lâcher dans la nature des moustiques génétiquement modifiés générant une descendance biaisée à 90 % en faveur des mâles, contrairement à la proportion naturelle de 50 %. L’objectif est de réduire drastiquement les populations de moustiques pour enrayer la malaria, transmise uniquement par les moustiques femelles.
Le CRISPR à l’œuvre
Ce ne sont là que trois exemples parmi les nombreux projets de recherche menés dans les domaines combinés de la biologie moléculaire, de la microbiologie et de la génétique, mais également des technologies de l’information et de l’automation. Les nouvelles techniques de modification génétique ciblée, comme la modification du génome grâce au système d’enzymes CRISPR/Cas (voir encadré ci-contre), revêtent un potentiel particulièrement intéressant car elles sont efficientes, précises, peu coûteuses et largement accessibles. À la différence des procédés classiques, le plus souvent utilisés pour transférer des informations génétiques entre espèces (transgenèse), les techniques d’édition génomique (genome editing en anglais) comme le CRISPR/Cas permettent de modifier le génome de façon ciblée sans forcément introduire de gènes étrangers à l’espèce. On peut les comparer à des ciseaux génétiques réalisant des coupes à des endroits précis du génome, pour désactiver certains gènes. La technique permet également de remplacer des segments d’ADN
défectueux ou d’insérer de nouvelles séquences génétiques dans un organisme, non seulement des gènes isolés mais des groupes et des combinaisons de gènes, et ce à divers endroits du génome.
Les derniers progrès biotechnologiques en date ont entraîné une augmentation notable du nombre d’applications dans le domaine non humain, tout particulièrement dans le secteur pharmaceutique, où l’on a recours à des microorganismes génétiquement modifiés pour produire des médicaments et des vaccins, ainsi qu’en médecine (thérapie génique, diagnostic), dans l’agriculture (plantes cultivées), la sylviculture (arbres destinés à la production de bois et de papier) et l’industrie, qui utilise des algues, des champignons ou des bactéries génétiquement modifiés pour produire huiles, enzymes, vitamines et arômes.
Dans le domaine de la sélection animale également, l’utilisation du génie génétique ouvre continuellement de nouvelles possibilités. L’accent y est mis sur la résistance aux maladies infectieuses, l’augmentation de la masse musculaire, la suppression de certains allergènes dans le lait ou encore l’amélioration des propriétés de la laine. À ce stade, les récentes techniques d’édition génomique semblent plus prometteuses que les technologies génétiques classiques. On trouve déjà sur le marché des poissons d’aquarium fluorescents ou des produits à base de saumon modifié génétiquement pour croître plus rapidement tout en étant moins nourri. Tous deux sont pour l’instant encore interdits en Suisse, puisque la production et la mise en circulation de vertébrés génétiquement modifiés ne sont autorisées qu’à des fins scientifiques, thérapeutiques et diagnostiques sur l’être humain ou l’animal.
Cependant, à la fin de l’année 2018, une nouvelle a provoqué l’émoi lors du Sommet international sur l’édition du génome humain. Malgré les appels répétés à la prudence de la part des deux chercheuses à l’origine de la découverte du CRISPR/Cas, la naissance en Chine de deux jumelles modifiées au moyen de cette technique pour déjouer l’infection du virus du sida a été confirmée. Cette annonce a soulevé une vague de doutes et de questionnements sur la liberté et les objectifs de la recherche, et pointé la nécessité de formuler des règles pour la société. Il convient toutefois de préciser que le droit suisse interdit strictement de telles modifications du génome humain.
Des systèmes biologiques artificiels
Une autre impulsion devrait provenir de la biologie synthétique, un domaine de recherche récent, situé à la jonction entre la biologie moléculaire, la chimie, l’ingénierie, les biotechnologies et les technologies de l’information (voir encadré, article « Reproduire pour mieux comprendre »).
Des chercheurs de diverses disciplines s’associent en vue de développer des systèmes biologiques tels que des cellules, des molécules et des tissus en laboratoire, ainsi que de mettre au point des organismes dotés de nouvelles caractéristiques spécifiques.
À la différence du génie génétique classique, il ne s’agit pas de transférer des gènes distincts (et d’espèce étrangère) dans un organisme, mais d’y introduire des éléments et des systèmes biologiques nouveaux ou modifiés (p. ex. une voie métabolique impliquant plusieurs gènes), de façon à ce qu’ils produisent une substance donnée – médicament, arôme ou biocarburant. Ces procédés permettent également d’obtenir des matériaux qu’aucun organisme ne produit naturellement, comme du butane-1,4-diol, une substance chimique de base destinée à la fabrication de matières plastiques, elle-même produite selon un processus de synthèse qui n’existe pas dans la nature. On emploie par ailleurs fréquemment des gènes dont la séquence ADN a été conçue par ordinateur afin de remplir une fonction donnée.
Le recours accru au génie génétique engendre de nouveaux défis en matière de sécurité. Et la principale difficulté, du point de vue de la protection de l’environnement, concerne la libération, intentionnelle ou non, d’organismes génétiquement modifiés (OGM) dans la nature. En effet, les OGM sont comme les autres organismes vivants : ils se multiplient, se mélangent et se modifient. Or la propagation involontaire concerne non seulement les organismes modifiés eux-mêmes, mais également les modifications génétiques qui leur ont été apportées, lesquelles peuvent se transmettre de manière tant verticale (par la descendance) qu’horizontale (par transfert de matériel génétique à d’autres organismes) et nuire ainsi à la santé humaine et animale, ainsi qu’à l’environnement et à la biodiversité.
Vidéo «What ist a Gene Drive» (en anglais)
Des interventions directes dans l’environnement
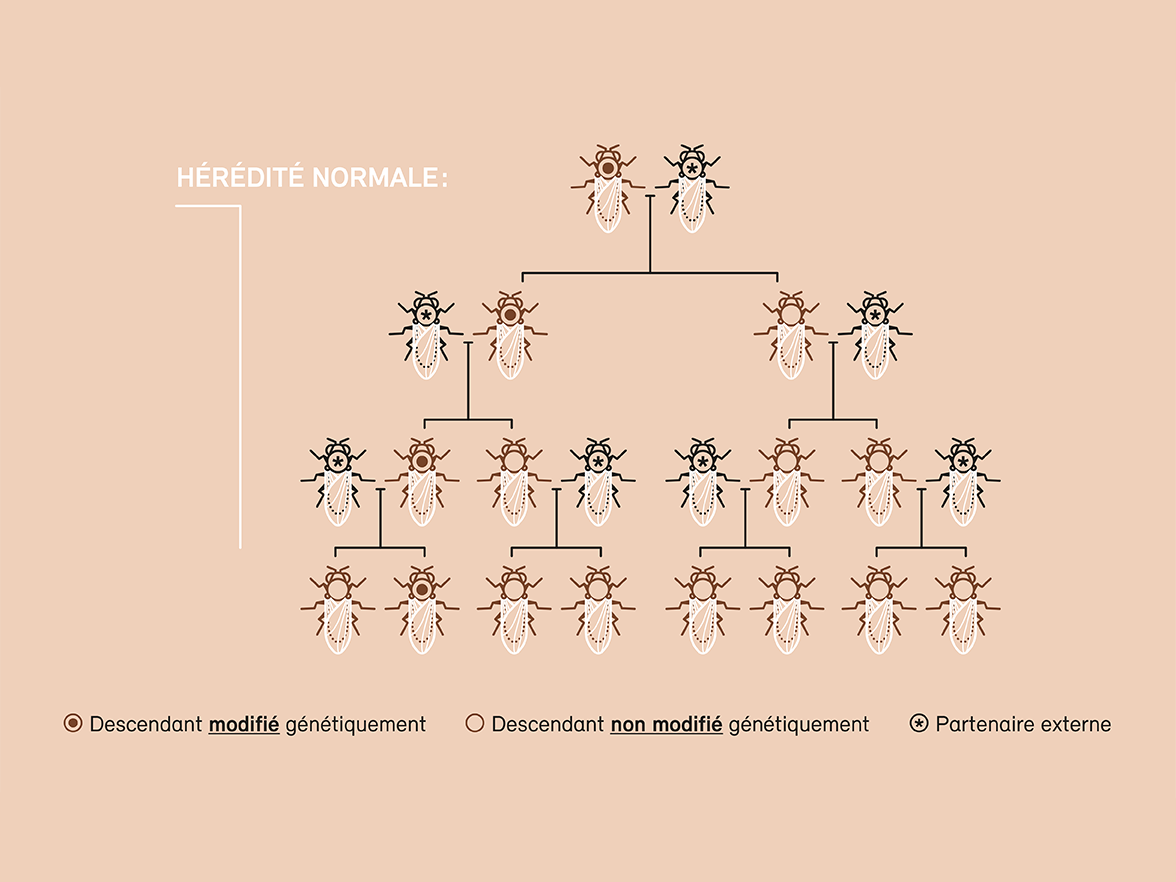
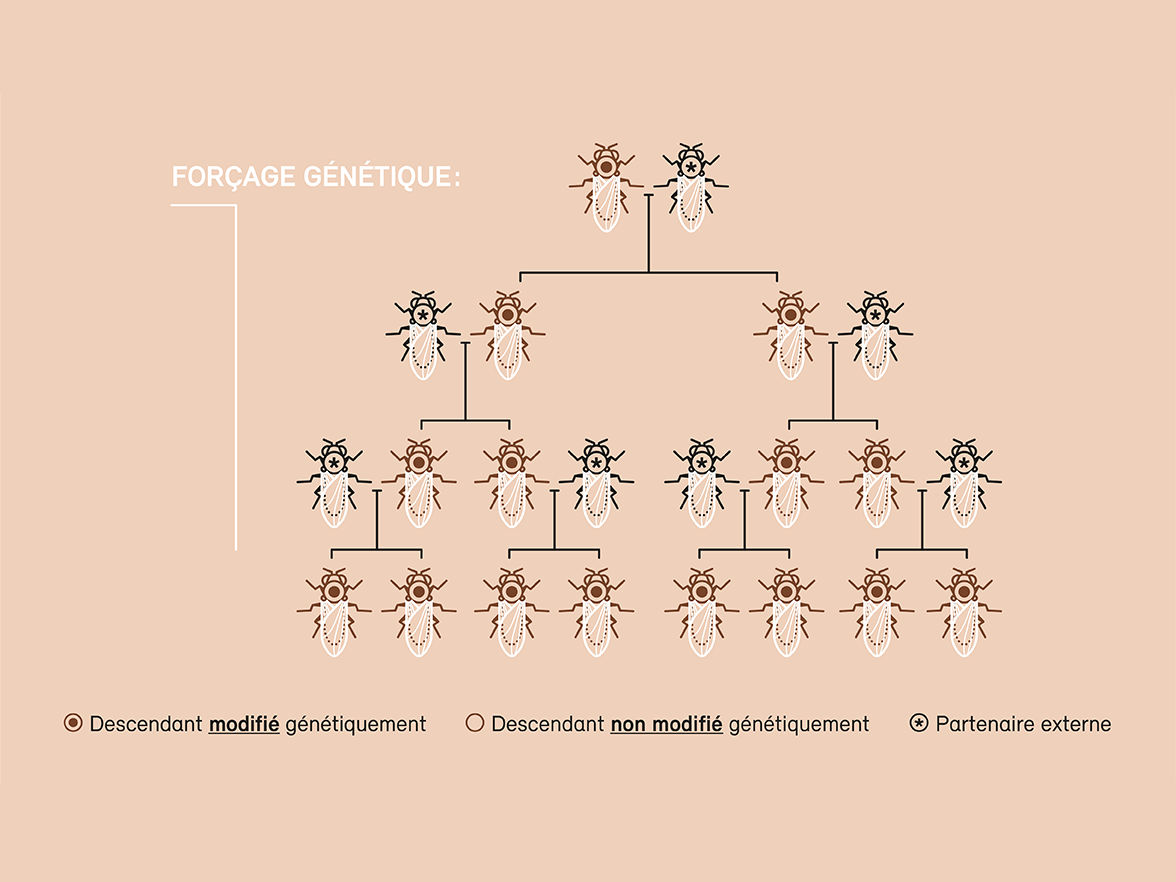
Le forçage génétique (gene drive, en anglais) pose un défi tout particulier en matière de sécurité et de protection de l’environnement (voir graphique). Cette méthode permet d’introduire une mutation génétique dans une population naturelle et de la propager à l’ensemble des individus. Alors qu’une modification génétique n’est transmise qu’à la moitié des descendants par le biais de la reproduction sexuée et disparaît donc au fil des générations, le forçage génétique permet d’inoculer la modification souhaitée à l’ensemble des descendants et de la diffuser ainsi rapidement au sein d’une population. Cette technique offre de nombreuses applications possibles, et peut servir par exemple à contenir ou éradiquer des nuisibles, des vecteurs de maladies ou des espèces exotiques envahissantes. Les essais en laboratoire ont d’ores et déjà confirmé le fait que cette approche fonctionne. Il n’est toutefois guère possible d’évaluer comment l’élimination d’une population ou d’une espèce pourra se répercuter sur l’écosystème ou sur la biodiversité.
L’OFEV suit attentivement l’évolution des biotechnologies. Il mène divers programmes de surveillance et s’assure du respect des dispositions légales régissant leur utilisation. Les processus biotechnologiques – que ce soit dans le domaine de la recherche ou de la production – doivent être encadrés de manière sûre. « Le défi consiste à repérer au plus tôt les éventuels risques pour l’être humain et pour l’environnement, à les évaluer et à prendre les mesures qui s’imposent », explique Anne Gabrielle Wüst Saucy, cheffe de la section Biotechnologie de l’OFEV. Cette appréciation s’avère particulièrement délicate dans le contexte des nouvelles technologies, car les expériences sont insuffisantes : « Dans bien des cas, l’état d’avancement de la science ne nous permet pas d’évaluer de manière adéquate les effets des modifications apportées sur le génome et les risques qui en découlent. » Comme il existe des raisons plausibles de craindre que l’utilisation d’OGM ait des répercussions néfastes sur l’environnement et la santé des plantes, des animaux et des êtres humains, le principe de précaution s’impose. Outre un devoir général de diligence, la loi sur le génie génétique (LGG) prescrit par conséquent une évaluation des risques au cas par cas et l’application de mesures de sécurité appropriées. Elle impose par ailleurs un régime obligatoire de notification, d’autorisation et d’information.
La culture de la biosécurité
L’un des principes fondamentaux concernant les OGM est celui de l’analyse au cas par cas, qui consiste à examiner chaque projet du point de vue des risques qu’il présente, sur la base de scénarios vraisemblables. Un autre principe est celui de la progression par étapes, qui exige d’acquérir suffisamment d’informations au cours de chaque phase avant de passer à la suivante. En général, ces étapes correspondent aux différentes expériences en milieu confiné (p. ex. en laboratoire et sous serre) et en plein champ. Ce n’est qu’une fois que l’innocuité de l’organisme a été prouvée par de nombreuses données qu’il sera possible, le cas échéant, de l’exploiter sous forme de produit. Grâce à ces règles et à une « culture de la biosécurité » qui s’est développée durant ces 25 dernières années, aucun incident grave de dissémination incontrôlée n’a été enregistré en Suisse lors de l’utilisation (volontaire) d’OGM. « Mais l’actuel essor des biotechnologies requiert que nous redoublions d’efforts en matière de biosécurité et d’évaluation des risques pour l’environnement », conclut Anne Gabrielle Wüst Saucy.
CRISPR/Cas : le « couteau suisse » du génie génétique
Le système CRISPR/Cas se base sur un mécanisme immunitaire des bactéries qui leur permet de se protéger des virus. En cas d’infection de la bactérie, l’ADN viral est découpé en infimes fragments, puis intégré dans le CRISPR – des séquences courtes et répétées présentes dans le génome des bactéries. Les séquences d’ADN introduites servent de signal de reconnaissance en cas d’infection ultérieure par le virus. L’autre composante du système, les gènes Cas, contient les instructions nécessaires à la synthèse d’une protéine capable de découper les brins d’ADN (d’où le nom de « ciseaux génétiques »). En cas de nouvelle infection, les séquences d’ADN sont retranscrites en ARN : cette « sonde génétique » examine la séquence d’ADN du virus. Quand elle identifie la séquence connue, elle se fixe à l’ADN viral et indique aux ciseaux génétiques de le découper pour stopper l’infection.
En 2012, des chercheurs ont démontré pour la première fois que le système CRISPR/Cas pouvait être utilisé comme des ciseaux génétiques programmables sur des microorganismes. Il a ensuite été établi que ce système fonctionnait aussi sur des organismes supérieurs, comme les animaux ou les végétaux.
Le processus se déroule en trois étapes : il s’agit d’abord de déterminer très précisément la séquence à modifier, sachant que le génome se compose en principe de plusieurs milliards de paires de bases (éléments constitutifs de l’ADN). Cette séquence est ensuite introduite dans un complexe CRISPR/Cas, que l’on insère dans la cellule de l’organisme récepteur. La cellule produit elle-même la « sonde génétique » et les ciseaux moléculaires qui l’accompagnent. Les ciseaux sont dirigés vers le gène ciblé et découpent le double brin d’ADN à l’endroit précis indiqué par la sonde.
Enfin, les mécanismes de réparation propres à la cellule entrent en action. Dans le premier mécanisme, le brin d’ADN coupé se ressoude, en laissant toutefois de petites anomalies. Résultat : le gène concerné ne peut plus être lu ni fonctionner correctement. Dans le second mécanisme, la cellule utilise une copie de la séquence génétique comme modèle. Ces modèles peuvent être produits artificiellement et insérés dans les cellules. Il est ainsi possible d’« éditer » (de l’anglais to edit) la séquence presque à volonté, notamment en intégrant des séquences d’ADN supplémentaires. C’est pourquoi on parle d’outils d’édition génomique.
Informations complémentaires
Dernière modification 29.05.2019